近日,Respiratory Research(IF 7.16)上刊载了由四川大学华西医院李为民教授团队联合8455新葡萄娱集团am的重要科研成果[1]:“Early detection and stratification of lung cancer aided by a cost-effective assay targeting circulating tumor DNA (ctDNA) methylation(低成本检测方法循环肿瘤DNA (ctDNA)甲基化有助于肺癌的早期检测和分层)”
 文章发表在Respiratory Research
文章发表在Respiratory Research
肺癌为世界范围内癌症相关死亡的主要原因,其总体5年生存率仅21.7%,但早期肺癌的5年生存率可提升至59.8%[2]。低剂量计算机断层扫描(LDCT)可以有效发现早期肺癌,然而,由此可能带来的良性结节过度诊断,又很大程度上限制了LDCT作为肺癌主要筛查工具的广泛应用 [3]。因此,迫切需要一个新的非侵入性方法用于肺癌早期检测和结节鉴别诊断。
循环肿瘤DNA(ctDNA)甲基化已成为肿瘤领域的诊疗新热点,在多个癌种中表现出高敏感性和特异性[4],但在肺癌现有的研究报道中还尚未发现高性能的早期生物标志物。此外,现有研究多基于高通量测序(NGS),其流程复杂、成本较高,难以在临床实践中推广。
本研究中,研究团队旨在开发一种经济有效、基于多重qPCR技术的肺癌ctDNA甲基化检测方法——LunaCAM,并评估其在肺癌早期发现和结节鉴别诊断临床实践中的应用价值。
 图1 研究设计
图1 研究设计
研究结果
LunaCAM 的开发
研究人员在过往PanSeer panel的基础上,整合文献报道的肺癌差异甲基化区域 (DMR),对429例血浆样本进行甲基化分析,筛选出前50个DMRs(图2A)。这些标志物区分肺癌和健康对照/良性病变的AUC分别为0.95和0.85(图2B)。
研究人员进一步优化候选甲基化标志物的数量,使其可以用多重qPCR实现,最终选择出11种具有更高检测性能的标志物,并命名为LunaCAM(图2C和2D)。
 图2 LunaCAM 标志物的筛选和优化
图2 LunaCAM 标志物的筛选和优化
LunaCAM 模型的构建
研究者基于513例血液样本(包括肺癌、肺部良性病变和健康者)构建了LunaCAM-S(一般风险人群的早期筛查)和LunaCAM-D(高风险人群的结节良恶性鉴别)模型。
-
LunaCAM-S在训练集中平均AUC达到0.90,可检出91.6%的肺癌患者。
-
LunaCAM-D在训练集中区分肺癌和良性病变的特异性较高,其AUC平均为0.81。
表1 LunaCAM 模型的检测性能

LunaCAM 模型的性能验证
本研究进一步在一个独立队列(包含64例肺癌、45例良性病变和63例健康人)中对LunaCAM-S和LunaCAM-D模型进行盲法验证。
-
LunaCAM-S在验证集中的肺癌检出率为90.6%,AUC达到0.90,与训练集中的检测性能相似(图3A)。
-
LunaCAM-D在验证集中区分肺癌和良性病变的AUC同样可以达到0.81,和训练集保持一致(图3C)。
-
若在LunaCAM-S阳性的人群中串联使用LunaCAM-D模型,则83.3% 被LunaCAM-S误判的患者可以得到纠正。两个模型联合使用后,肺癌的敏感性可达50%,特异度高达94.4%(图4A和4B)。
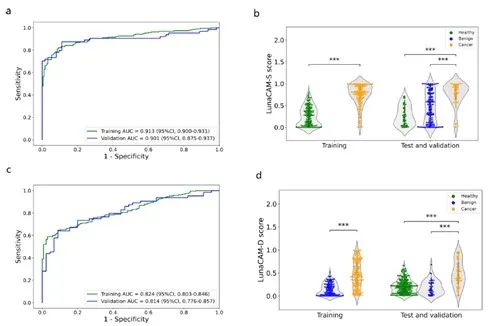 图3 LunaCAM 模型的构建和验证
图3 LunaCAM 模型的构建和验证
LunaCAM 模型在临床应用中的价值
-
LunaCAM模型可以在早期检测到癌症信号。
√ 将训练集和验证集样本合并后,LunaCAM-S检测I期肺癌的敏感性高达87.0%;而LunaCAM-D检测I期肺癌的敏感性为49.1%,特异性则分别高达96.7%(良性病变)和87.3%(健康对照)(表1)。
-
LunaCAM-S模型对于体积相对较小的肿瘤也有较高的检测敏感性。
√ LunaCAM-S可以检出86%(12/14)结节直径小于1.2cm的肿瘤。
-
LunaCAM-D在肺癌所有疾病阶段中的表现均优于CEA(AUC:0.81 vs 0.56),且整合CEA和LunaCAM-D后可进一步提升检测性能,AUC达到0.86(图4C)。
 图4 LunaCAM 模型在临床应用中的价值
图4 LunaCAM 模型在临床应用中的价值
小结
本研究基于多重PCR技术开发了两种不同的肺癌模型LunaCAM-S和LunaCAM-D,在肺癌的早期检测和鉴别诊断中表现出较高的性能,有望为肺癌的早检、早诊提供一种新的简便且经济有效的非侵入性检测方法。
参考文献
[1] Wang Z, Xie K, et al. Early detection and stratification of lung cancer aided by a cost-effective assay targeting circulating tumor DNA (ctDNA) methylation. Respir Res. 2023 Jun 17;24(1):163.
[2] De Angelis R, Sant M, et al. Cancer survival in Europe 1999–2007 by country and age: results of EUROCARE–5-a population-based study. Lancet Oncol. 2014; 15:23–34.
[3] Jonas DE, Reuland DS, et al. Screening for Lung Cancer with Low-Dose Computed Tomography: updated evidence report and systematic review for the US Preventive Services Task Force. JAMA. 2021;325:971–87.
[4] Klein EA, Richards D, et al. Clinical validation of a targeted methylation-based multi-cancer early detection test using an independent validation set. Ann Oncol. 2021; 32:1167–77.









